[미디어펜=김견희 기자]식품의약품안전처는 5일 셀트리온의 신종 코로나바이러스 감염증(코로나19) 항체치료제 '렉키로나주'(성분명 레그단비맙·코드명 CT-P59)의 조건부허가 여부와 아스트라제네카 코로나19 백신 중앙약사심의위원회의 심사 결과를 발표한다.
| |
 |
|
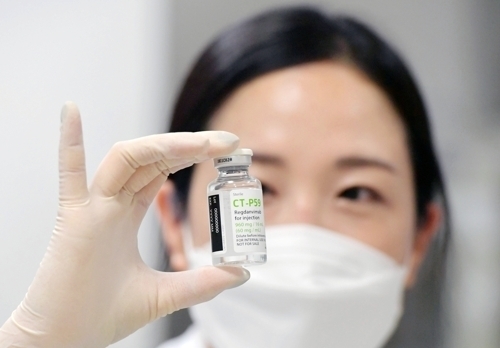
| ▲ 셀트리온의 항체치료제 렉키로나주./사진=연합뉴스 |
식약처는 이날 오전 10시 최종점검위원회를 열고 렉키로나주에 대한 전문가 의견, 효능·효과, 권고사항을 종합해 허가 여부를 판단하고 그 결과를 오후에 공개한다. 만약 렉키로나주가 조건부 허가 될 시엔 첫 국산 코로나19 치료제가 된다.
최종점검위원회 자문은 식약처가 3중으로 마련한 코로나19 치료제 허가심사의 외부 전문가 자문 절차 중에서 마지막 단계다.
코로나19 의약품은 허가 전 검증자문단, 중앙약사심의위원회(중앙약심), 최종점검위원회 회의를 거친다. 앞서 검증자문단은 렉키로나주의 임상 3상을 시행하는 것을 전제로 품목허가를 권고한 바 있다.
렉키로나주의 임상 2상 결과 코로나19 환자가 회복하는 데 걸리는 시간은 5.34일, 위약 투여군은 8.77일이었다. 렉키로나주를 투여한 코로나19 환자는 3.43일 정도 빨리 회복된 것으로 나타났다.
다만 코로나19 바이러스 검사 결과 양성에서 음성으로 전환되는 시간(바이러스 음전 소요 시간)이 임상적으로 의미가 없고, 사망률에 대한 효과는 알 수 없다고 봤다.
앞서 중앙약심 회의에선 품목허가를 권고했지만, 투여 환자 범위를 고위험군 경증 환자와 중등증 환자로 좁혀야 한다는 의견을 냈다. 경증환자에게서는 통계적으로 유의한 수준의 치료 효과를 확인하지 못했다는 이유에서다.
아스트라제네카의 코로나19 예방 백신의 두번째 자문 결과도 이날 오전 발표된다.
당초 식약처는 전날인 4일 오후 백신의 국내 품목허가 심의를 진행했지만 밤 늦은 시간까지 회의가 이어져 발표를 하루 미뤘다. 업계에선 중앙약심 위원회가 '만 65세 이상 고령자 접종 여부'를 두고 고심한 것으로 전해진다.
아스트라제네카 백신은 유럽의약품청(EMA)에서 만 18세 이상 모든 연령에게 접종을 허용하고 있지만 독일, 프랑스, 스웨덴에서 고령자 투여 근거가 부족하다는 판단을 내려 접종 연령을 제한했다. 또 스위스는 최근 해당 백신의 허가를 거부하기도 했다.
하지만 국내에서는 앞서 검증자문단을 통해 만 65세 이상에도 접종이 가능하다는 의견이 나왔던 만큼 전 연령층 대상으로 가닥이 날 것으로 업계는 내다봤다.
[미디어펜=김견희 기자]
▶다른기사보기