[미디어펜=김견희 기자]식품의약품안전처가 오는 31일 아스트라제네카 신종 코로나바이러스 감염증(코로나19) 백신 임상시험 자료 검토를 위해 검증 자문단 회의를 연다. 결과는 다음날 공개된다.
| |
 |
|
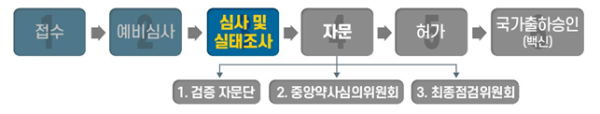
| ▲ 식품의약품안전처의 코로나19 백신 및 치료제 심사 절차./자료=식품의약품안전처 제공 |
식약처는 이달 4일 아스트라제네카 백신의 품목허가 신청을 접수하고 비임상·임상시험 자료와 품질자료 심사를 진행 중이다.
앞서 식약처는 지난 18일부터 사흘 간 아스트라제네카 백신을 위탁생산하는 SK바이오사이언스 제조소 실태조사를 완료했다. 아스트라제네카 제품이 바이러스벡터 백신인 만큼 제조소 내 유전자변형생물체 관리, 생물안전등급(BSL) 사항 점검은 필수다.
백신의 예방효과는 임상 참여자 중 코로나19 감염환자가 목표 수에 도달하면 백신접종군(시험군)과 위약접종군(대조군)의 감염환자 비율로 평가한다. 백신접종군과 위약접종군 간 코로나19 중증 환자 발생률을 비교해 백신접종으로 중증 환자의 발생을 얼마나 줄일 수 있는지 예측할 수 있다. 세계보건기구(WHO)는 코로나19 백신의 예방효과가 50% 이상인 것을 권고하고 있다.
백신의 안전성은 영국(2건), 브라질, 남아프리카공화국에서 수행된 4건의 임상 결과를 통합해 평가하고 있다. 백신접종군과 위약접종군을 동시에 모니터링해 비교 평가하며, 접종 후 28일 이내의 모든 이상 사례를 검토한다. 또 투여 후 1년간 추적 조사를 시행한다.
사망 사례를 비롯해 아나필락시스 등 중대한 부작용을 중점적으로 검토하고, 백신과 인과관계가 있다고 판단되면 위해성 관리계획의 안전성 중점검토 항목으로 관리하는 방안을 고려한다.
식약처는 65세 이상 고령자에게서 특별히 주의가 요구되는 안전성 정보가 있는지 검토하고 있다. 영국의 긴급사용 승인 시 평가된 4건의 임상시험에서 만 65세 이상 고령자의 비율은 안전성 평가 대상자의 약 10%다.
[미디어펜=김견희 기자]
▶다른기사보기