[미디어펜=김견희 기자]국내 제약·바이오 기업들이 연내 임상 3상 진입을 목표로 신종 코로나바이러스 감염증(코로나19) 백신 개발에 열을 올리고 있다. 최근 변이 바이러스 등장과 백신 부작용 이슈가 불거지면서 무리하게 개발 속도를 내기보다 부작용 최소화 등 신중하게 접근하는 분위기다.
| |
 |
|
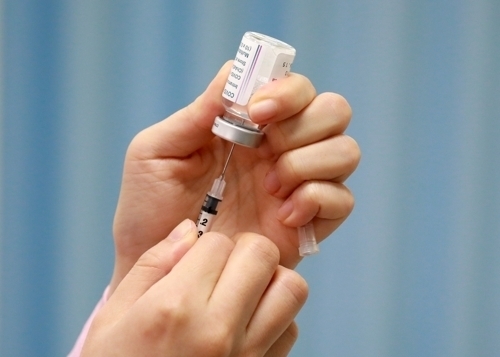
| ▲ 마포구 보건소에서 한 의료진이 보건의료단체장 아스트라제네카 코로나19 백신 접종을 앞두고 백신을 주사기에 담고 있다./사진=연합뉴스 |
15일 식품의약품안전처에 따르면 SK바이오사이언스, 유바이오로직스, 셀리드, 제넥신, 진원생명과학 등 총 5개 회사가 코로나19 백신 개발을 위한 임상시험 중에 있다.
임상 속도가 가장 빠른 곳은 제넥신이다. 제넥신은 지난해 6월 'GX-19'의 임상 1/2a상에 착수했다가 뉴클리오캡시드 항원을 추가로 탑재해 변이 바이러스에도 대응이 가능한 후보물질 'GX-19N'로 변경해 연구를 진행하고 있다. 지난 2월 임상 1상을 마무리하고 데이터를 분석 중에 있으며 결과는 이달 중 발표할 예정이다.
제넥신은 1상에 이어 2a상에 해당하는 투약을 지난달 초 시작했으며 중간결과까지 약 10주 정도 소요될 것으로 회사는 예상하고 있다. 또 55~58세 고령층 대상 추가 임상1상도 진행 중이다. 이 밖에도 글로벌 임상 2/3상도 착수했다. 제넥신은 지난달 인도네시아에 임상 2/3상 시험계획을 신청한 바 있다. 제넥신은 인도네시아 1000명을 비롯해 전 세계 총 3만명을 대상으로 연구를 진행할 계획이다.
SK바이오사이언스는 백신 후보물질 'NBP2001'과 'GBP510'로 임상 진행 중이다. NBP2001은 SK바이오사이언스가 독자적으로 개발한 코로나19 백신 후보물질이며 빌앤멜린다게이츠 재단과 함께 개발하고 있는 후보물질이다.
NBP2001은 지난해 11월 임상 1상 승인을 얻었으며 올해 1월 마지막 투약을 완료했다. GBP510은 지난해 12월 임상 1/2상 승인을 받고 올해 1월부터 투약을 시작해 2분기까지 완료하겠다는 게 회사의 계획이다. SK바이오사이언스 관계자는 "두 후보물질에 대한 임상시험 중간결과를 올해 3분기쯤 확보하고 대규모 임상 3상을 진행할 것"이라고 말했다.
진원생명과학은 지난해 12월 GLS-5310 임상 1/2a상을 승인받았다. 현재 임상 1상에서 45명 피험자 모집을 완료하고 2차 투여를 진행하고 있다. 상반기 내 이들에 대한 투약을 완료한 이후 하반기쯤 임상 2a상 진행한다는 계획이다. 또 중간결과를 확보하는 대로 임상 3상에 진입하겠다는 목표다.
셀리드는 지난해 12월 'AdCLD-CoV19'에 대한 임상 1/2a상을 승인받았다. 현재 환자 투약을 완료하고 안전성과 관련한 데이터를 분석 중이며 이달 중 중간결과를 발표한다는 계획이다. 아울러 이 회사는 지난달 말 2a상 첫 투약도 시작했다. 셀리드는 상반기까지 2a상을 마무리하고 2b상을 이어갈 예정이다.
셀리드는 개발 과정에서 '특이 혈전'과 관련한 부작용 반응도 주의깊게 살핀다는 방침이다. 셀리드가 개발 중인 백신은 최근 혈전 이슈로 논란이 일고 있는 아스트라제네카, 얀센 백신과 동일한 플랫폼인 바이러스 벡터 방식으로 개발된다.
강창율 셀리드 대표이사는 "셀리드에서 개발 중인 백신은 아스트라제네카, 얀센과는 사용하는 서브타입이 달라서 꼭 똑같은 부작용이 발생한다고 단언하기는 어렵다"면서 "특이 혈전은 이전에도 특정한 약물이나 사항으로 발생할 수 있는 질환 중 하나로 유전적 요소가 됐든 환경적인 요인을 가진사람에게서 발생하는 질환이다"고 설명했다.
유바이오로직스는 올해 1월 '유코백-19'의 임상 1/2상 계획을 승인받았다. 피험자를 대상으로 투약을 진행 중이며 막바지 단계에 이른 것으로 파악된다. 유바이오로직스는 이번 임상이 완료되는대로 안전성, 면역성과 관련한 데이터 분석을 거쳐 중간결과를 상반기 내 발표할 계획이다.
[미디어펜=김견희 기자]
▶다른기사보기